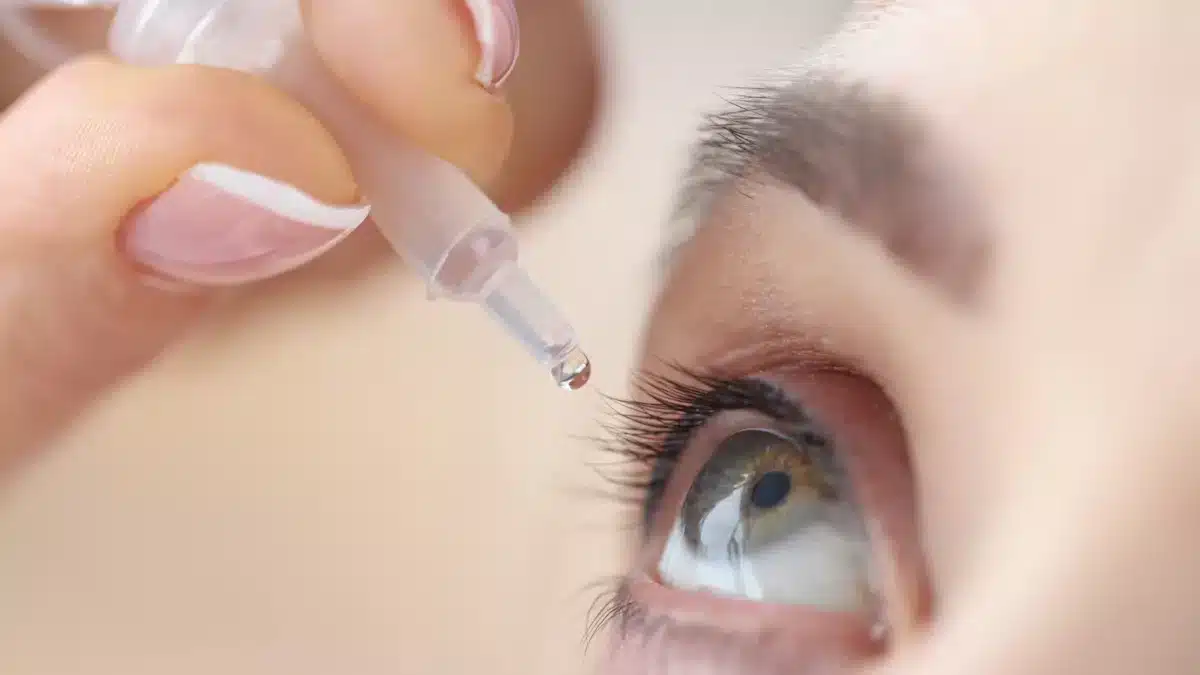
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha emitido una alerta sanitaria urgente ordenando la retirada inmediata de siete lotes del colirio Bilaxten 6 mg/ml, un antihistamínico ampliamente utilizado para tratar síntomas de alergias oculares como picor, enrojecimiento y lagrimeo.
La decisión se tomó tras detectarse la presencia de partículas visibles en el producto, causadas por la precipitación del principio activo, la bilastina, lo que constituye un defecto de calidad.
Los lotes afectados, fabricados por Famar Health Care Services Madrid y distribuidos por Faes Farma, incluyen los números 322950C, 323560A, 331400A, 331410A, 332070A, 332080A y 332440C, con fechas de caducidad entre mayo y septiembre de 2027.
Aunque la AEMPS ha clasificado el incidente como clase 2 —lo que indica que no supone un riesgo vital—, la retirada se realiza como medida preventiva para evitar posibles efectos secundarios como irritaciones o alteraciones en la eficacia del tratamiento.
Las autoridades sanitarias instan a farmacias, hospitales y pacientes a verificar los lotes en los envases y abstenerse de usar o dispensar las unidades afectadas. Quienes posean estos lotes deben devolverlos a través de los canales habituales.
Bilaxten, indicado principalmente para la rinoconjuntivitis alérgica, se administra en gotas oculares una vez al día, y su uso está aprobado para adultos.
Este episodio refleja los mecanismos de vigilancia farmacéutica en España, donde los controles rutinarios permiten identificar anomalías antes de que generen daños graves. La AEMPS enfatiza que, pese a la retirada, no se han reportado incidentes clínicos asociados a los lotes afectados.
No obstante, la medida subraya la importancia de garantizar estándares de calidad en medicamentos de aplicación directa en zonas sensibles como los ojos, donde cualquier irregularidad podría agravar condiciones preexistentes.
Te puede interesar
Lo más visto
![Feijóo y Ayuso se abrazan contra Sánchez: "Nos quieren divididos y vamos [...]](https://www.elindependiente.com/wp-content/uploads/2025/06/66da9a5059d96ce3d92307a434f1c11660894cde-350x365.jpg)
![Ayuso traslada su apoyo a la Guardia Civil ante un Gobierno "sin [...]](https://www.elindependiente.com/wp-content/uploads/2025/06/8e0b50f4a9daf3bd3080007aa9cd57a5d1cb65ed-350x365.jpg)
![Sánchez se felicita por sus siete años en el Gobierno: "Los datos [...]](https://www.elindependiente.com/wp-content/uploads/2025/03/europapress-6605575-presidente-gobierno-pedro-sanchez-interviene-sesion-plenaria-congreso-350x365.jpg)
![Los dos fallecidos en el tiroteo del paseo marítimo de Fuengirola (Málaga) [...]](https://www.elindependiente.com/wp-content/uploads/2025/05/europapress-5874655-coche-policia-nacional-llega-ciudad-justicia-vigo-abril-2024-vigo-350x365.jpg)


![Dos muertos y 559 detenidos en los altercados tras la victoria de [...]](https://www.elindependiente.com/wp-content/uploads/2025/06/14046fda0554507474122b0b6c614a1cd3688e34-350x365.jpg)
![Tropas israelíes matan a al menos 30 gazatíes al atacar puntos de [...]](https://www.elindependiente.com/wp-content/uploads/2025/06/be69416a960a5d8c0a398f27e5789ed4594810c0-350x365.jpg)




Comentarios
Normas ›Para comentar necesitas registrarte a El Independiente. El registro es gratuito y te permitirá comentar en los artículos de El Independiente y recibir por email el boletin diario con las noticias más detacadas.
Regístrate para comentar Ya me he registrado