Los ensayos clínicos son el último escalón antes de la aprobación de un medicamento, cuando éste se prueba en seres humanos para comprobar su seguridad y eficacia. Una parte fundamental de la investigación médica y para cuyo control el Ministerio de Sanidad creó en 2013 un registro obligatorio y público, dependiente de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps).
Siete años después, la Fundación Salud por Derecho acaba de presentar "La investigación clínica en España: un perfil de los ensayos clínicos a través de su registro", sobre la actividad del Registro Español de Estudios Clínicos (REEC) hasta septiembre de 2019. Durante este período se realizaron 5.221 ensayos clínicos de los cuáles sólo el 4% se dedicó al tratamiento de enfermedades víricas como el COVID-19. "Ahora vemos muy claro que investigar en enfermedades infecciosas debe ser una prioridad global pero no siempre ha sido así a pesar de que muchas entidades y organismos internacionales, entre ellos la OMS, veníamos alertando sobre ello desde hacía tiempo", incide una de las autoras del informe, Eva Iráizoz.
La investigadora lamenta que las víricas son enfermedades "menos atractivas para las grandes empresas farmacéuticas porque no generan beneficios tan altos como otras ni durante tanto tiempo o porque suelen afectar a países empobrecidos y ofrecen menos oportunidades de negocio, pero no puede ser que las prioridades de investigación vayan dirigidas exclusivamente por intereses económicos".
El análisis refleja que es el cáncer el que copa los ensayos, con uno de cada tres de los realizados entre 2013 y 2019. Una enfermedad "prioritaria", a juicio de Salud por Derecho, que sin embargo denuncia otras áreas "abandonadas" como las enfermedades transmitidas por virus o los antibióticos para tratar bacterias resistentes, "un gran problema de salud pública a escala global", según Iráizoz. La siguiente área en proporción de ensayos son las enfermedades del sistema nervioso, con un lejano 8%.
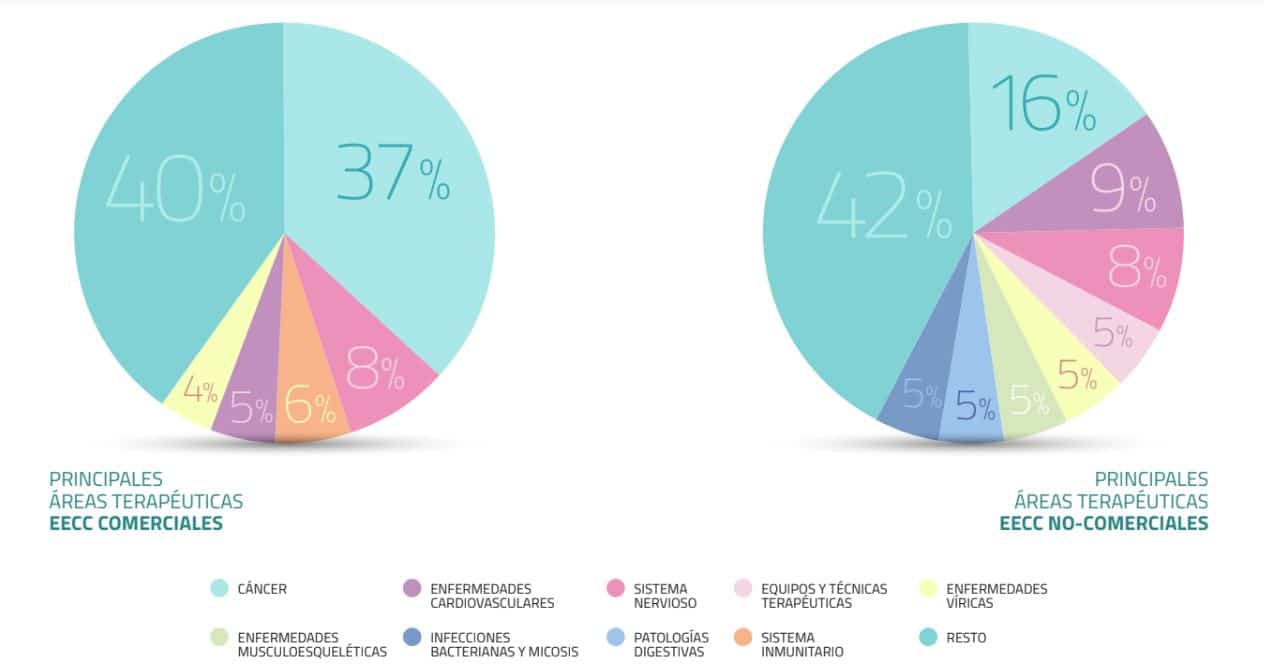
La falta de diversidad terapéutica está relacionada, según apunta la investigadora, con la financiación de los ensayos. Casi ocho de cada 10 están promovidos por las farmacéuticas y sólo un 15% están financiados y promovidos por centros públicos, universidades o entidades sin ánimo de lucro. En este tipo de ensayos, sí se ve una mayor distribución de los ensayos, con un 15,9%, las enfermedades cardiovasculares con un 9,3% o las víricas con un 5,3%.
Aunque el análisis se cerró antes del inicio de la epidemia, desde Salud por Derecho constatan que en España se han autorizado hasta la fecha 95 ensayos clínicos sobre COVID-19, de los que el 74% son de carácter público, un dato en la línea, asegura Iráizoz, con lo que está ocurriendo a nivel global. "Es necesario que esta enorme apuesta pública se proteja, tenga el retorno público que se espera, es decir, que se termine materializando en diagnósticos, terapias y vacunas accesibles y asequibles a un precio de coste", afirma la investigadora de una fundación que suele llamar la atención sobre el aumento de precios de los medicamentos. "En el caso de las futuras vacunas, esto es especialmente relevante porque debe garantizarse una producción a gran escala y que verdaderamente puedan llegar a todo el mundo, priorizando las poblaciones más afectadas y los grupos más vulnerables", añade.
Lagunas en la información del registro
Además de constatar a qué se están dedicando los ensayos clínicos, el informe revela que el cumplimiento de la transparencia requerida por el registro está muy lejos de lo exigido. Una cuarta parte de los ensayos finalizados no ha reportados los resultados obtenidos.
Otro dato revelador del informe es que una quinta parte de los ensayos no indican el principio activo que se investiga y que un 70% no reportan la fecha de finalización del ensayo (con lo que resulta imposible controlar si ha cumplido con la publicación de resultados a los 12 meses). "Esto es muy preocupante y se debe mejorar de manera urgente, no sólo como condición esencial para cumplir con la transparencia y la rendición de cuentas, sino por los pacientes y por el propio avance científico", apunta Iráizoz.
A la falta de datos se unen las dificultades al análisis derivadas, explica el informe, de la libertad en los formatos para cumplimentar la información. "La categorización es demasiado ambigua, no recoge supuestos como si el ensayo no ha sido autorizado, si se ha suspendido, si temporalmente se ha interrumpido o si ha terminado prematuramente", versa el informe. La información requerida del registro tampoco incluye, por ejemplo, el número de pacientes que participan.
Lo que sí ha constatado el informe es que todas las comunidades autónomas y Ceuta han puesto en marcha algún ensayo clínico durante el período y que la mayoría se realizan en centros hospitalarios de varios territorios. Así, tres cuartas partes de los ensayos pasan por Cataluña y Madrid (donde se registran 3.885 y 3.713 ensayos respectivamente), seguidas de Andalucía (2.308 ensayos) y Comunidad Valenciana (2.172).
Por ello, Iráizoz insiste en que el registro necesita mejorar la calidad de los datos y llama la atención sobre la AEMPS, agencia estatal responsable del mismo, para que "asegure que el registro responda al interés público, al avance científico y, al mismo tiempo, haga posible que los pacientes, los profesionales y la ciudadanía en general podamos acceder a información veraz, completa y de calidad". Para ello, añade, es necesario "actualizar y mejorar la precisión de la información, mejorar el reporte de resultados y establecer mecanismos de control y seguimiento que aseguren el cumplimiento de las normativas en relación a la transparencia y el reporte de los datos de los ensayos".
Te puede interesar
Lo más visto