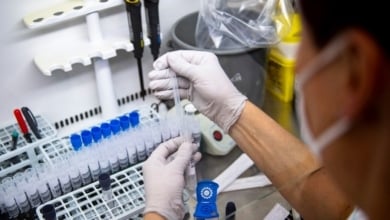
Genomica, la empresa de diagnóstico molecular del Grupo PharmaMar, ha informado de que ha obtenido el marcado 'CE' de conformidad para sus kits de diagnóstico del nuevo coronavirus, lo que acredita que cumple los requisitos esenciales descritos en la Directiva 98/79/CE sobre productos sanitarios para diagnóstico in vitro.
Genomica ha completado con éxito las pruebas realizadas con muestras de pacientes, en colaboración con el Instituto de Salud Carlos III. Estos kits son "altamente sensibles y específicos" en la detección del coronavirus, por lo que podría detectarse el virus incluso antes de que el paciente muestre síntomas.
Ya están disponibles comercialmente y son compatibles con las dos tecnologías de diagnóstico más utilizadas en hospitales y centros de salud: Clart de Genomica y PCR Real Time. La primera tiene tiene capacidad para analizar simultáneamente 96 muestras de pacientes en menos de cinco horas, lo que hace que sea una opción de diagnóstico para el cribado del virus en la población.
Genomica ya está en contacto con las autoridades sanitarias para proveer estos kits de diagnóstico según la demanda generada por la emergencia sanitaria por la infección Covid-19. Además, tiene acuerdos comerciales en más de 30 países, entre ellos China, donde ya puede empezar a distribuir estos kits.
Pharma Mar S.A. se ha disparado un 15,15 % en bolsa desde que anunciase que sus kits de diagnóstico cumplen los requisitos y desde que se pusieron a la venta.
Te puede interesar
Lo más visto