El organismo tiene una enorme capacidad de regeneración. Ante una herida, se activan una serie de mecanismos que permiten cerrarla, siempre que no sea muy grave. Sin embargo, esto no es tan fácil en casos de gran destrucción, como en las quemaduras más severas. Lo sorprendente es que no hay, técnicamente, nada, de forma genérica, que lo impida a nivel molecular. Hay animales capaces, como reptiles o medusas, de regenerar partes completas de su ser gracias a que reprograman parte de sus células. Eso es justo lo que acaba de conseguir en un mamífero un equipo internacional liderado por el español Juan Carlos Izpisúa Belmonte.
Sus integrantes han logrado curar en ratones heridas de este tipo regenerando su piel in vivo, es decir, en el propio organismo y sin necesidad de un trasplante.
El trabajo, basado en la reprogramación celular, "demuestra por primera vez que se puede inducir la regeneración de órganos en un mamífero y abre conceptualmente la puerta a la regeneración de nuestros órganos sin necesidad de trasplante", señala a Efe Izpisúa Belmonte, del Instituto Salk de California (EEUU) y autor principal del estudio. El científico está especializado en frenar el envejecimiento para evitar o retrasar la aparición de enfermedades vinculadas a él, como el cáncer. La técnica presentada, de funcionar en humanos, podría abrir una puerta al tratamiento de melanomas o la cirugía reconstructiva.
Los resultados se publican en Nature y participan también la Universidad Rey Abdullah de Ciencia y Tecnología (Arabia Saudí), la Universidad de Kyorin (Japón) y la Universidad Católica San Antonio de Murcia.
Células madre y virus en acción
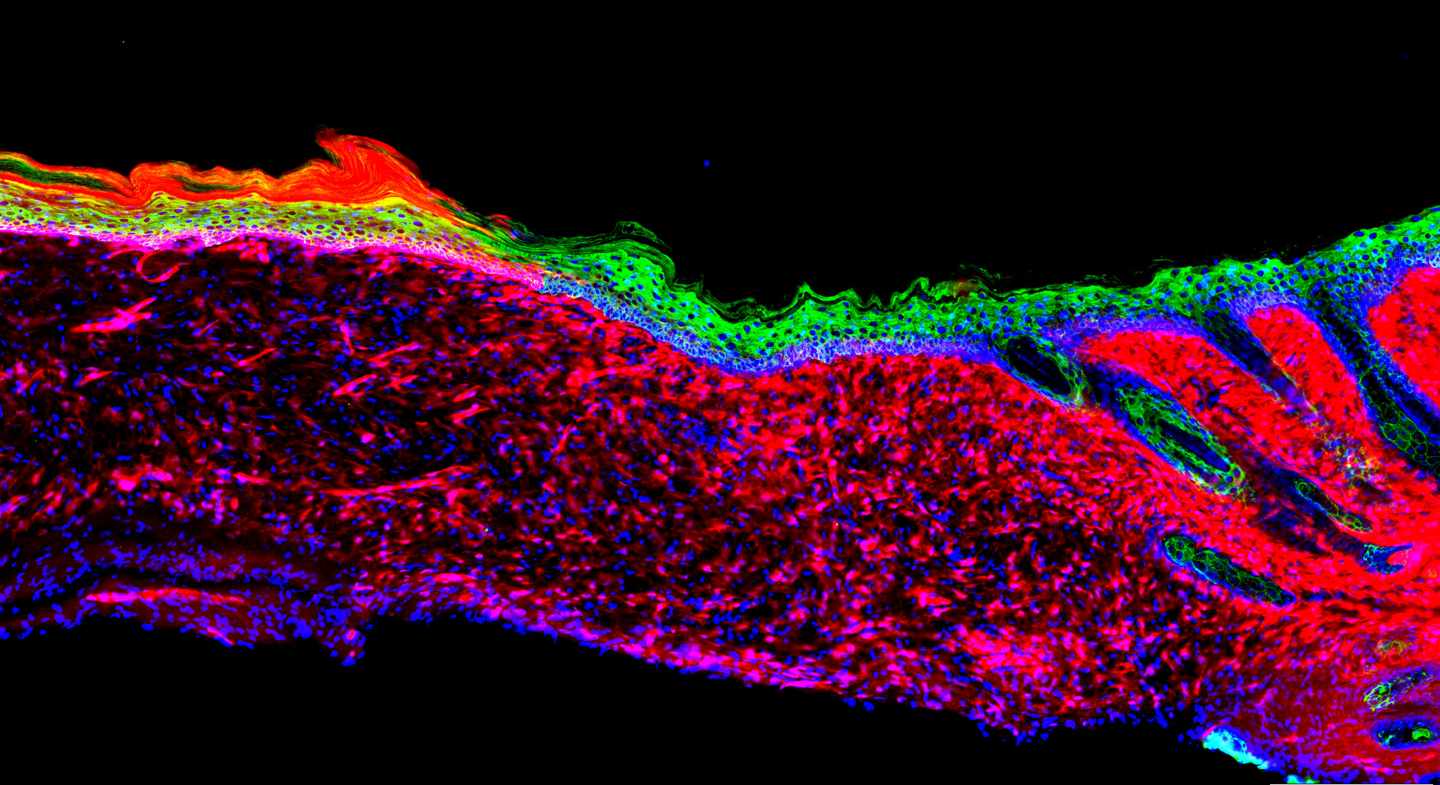
Para sellar el daño y que una herida se cure es necesaria la migración, desde el tejido circundante a la herida, de un tipo de células llamadas queratinocitos -casi toda la epidermis está compuesta de ellas-, pero cuando las heridas son grandes este proceso se vuelve ineficaz.
Esto provoca que la cicatrización sea imposible y con esto que heridas que en principio eran menores se transformen en heridas más graves o en úlceras dolorosas, a veces potencialmente mortales.
Los queratinocitos son células madre capaces de transformarse en los diferentes tipos de células de la piel. La técnica ahora para tratar una úlcera cutánea consiste en aislar esos queratinocitos a través de una biopsia, cultivarlos en el laboratorio, crear una capa de células epiteliales -los queratinocitos estimulan su crecimiento- y trasplantarla en el paciente; solo este proceso de creación e injerto dura al menos cuatro semanas y no todas esas láminas de células funcionan, así que algunos pacientes fallecen, apunta Izpisúa.
Precisamente uno de los objetivos de esta investigación es acotar el tiempo de este proceso, aumentando así su eficacia, y "conseguir una piel más natural generada por el propio organismo, que es funcionalmente distinta a la producida 'in vitro' en el laboratorio".
"Lo que hicimos en la úlcera del ratón fue reprogramar directamente en la misma las células del tejido conectivo -aquellas que ocupan los espacios entre órganos u otros tejidos- en queratinocitos".
Se identificaron cuatro proteínas para la reprogramación y por medio de un virus se transmitieron a las úlceras
Para ello, se identificaron cuatro proteínas que son claves para esta reprogramación celular y por medio de un virus se transmitieron a las úlceras de los ratones, logrando que creciera una piel sana -conocida como epitelial- en un plazo de 18 días.
Según una nota del Instituto Salk, con el tiempo este epitelio se expandió y se conectó con la piel circundante, incluso en úlceras grandes: ocho meses después, lo que constituye casi la mitad de la vida del ratón, las células generadas seguían funcionando y comportándose como células sanas de la piel.
Los científicos trabajan ahora por optimizar la técnica y comenzar a probarla en modelos animales adicionales a la úlcera, pero "antes de ir a la clínica hay que hacer más estudios sobre la seguridad a largo plazo de este enfoque y mejorar su eficiencia", relata Masakazu Kurita, también del Instituto Salk y otro firmante.
Si bien es una investigación en ratones, Izpisúa destaca que el objetivo final es regenerar en pacientes grandes superficies de piel para tratar grandes quemados o úlceras profundas que por ejemplo se dan en determinados casos de diabetes: si se pudiera llevar la regeneración de la piel 'in vivo' a humanos sería un avance importante para la medicina en general, no solo en medicina regenerativa, sino también en cirugía plástica o envejecimiento de la piel.
"Sin restarle ni un ápice de importancia a lo que se ha venido haciendo estas últimas décadas en la mayoría de laboratorios que trabajan en medicina regenerativa -generar células y órganos ex vivo para su posterior trasplante-, el concepto de poder inducir endógenamente la regeneración de nuestros propios órganos, como lo hacen ciertos organismos de manera natural -salamandra o pez cebra-, es un abordaje en paralelo con el que siempre hemos soñado y ahora estamos muy ilusionados". Aquí vemos cómo en el Hospital Gregorio Marañón de Madrid trabajan con ese concepto tradicional de cultivar células madre para imprimir tejidos que luego puedan implantarse en órganos dañados como el corazón.
Te puede interesar
Lo más visto