Crear vida de forma artificial es uno de los grandes sueños de la ciencia. Científicos de todo el mundo trabajan con el fin de que lograrlo sirva para solucionar problemas de salud que aún no tienen solución. Por ejemplo, crear órganos artificiales que eliminen las listas de espera de pacientes que necesitan e incluso mueren a la espera de un trasplante, o desvelar los misterios que hacen que la formación de vida fracase en las primeras etapas de gestación.
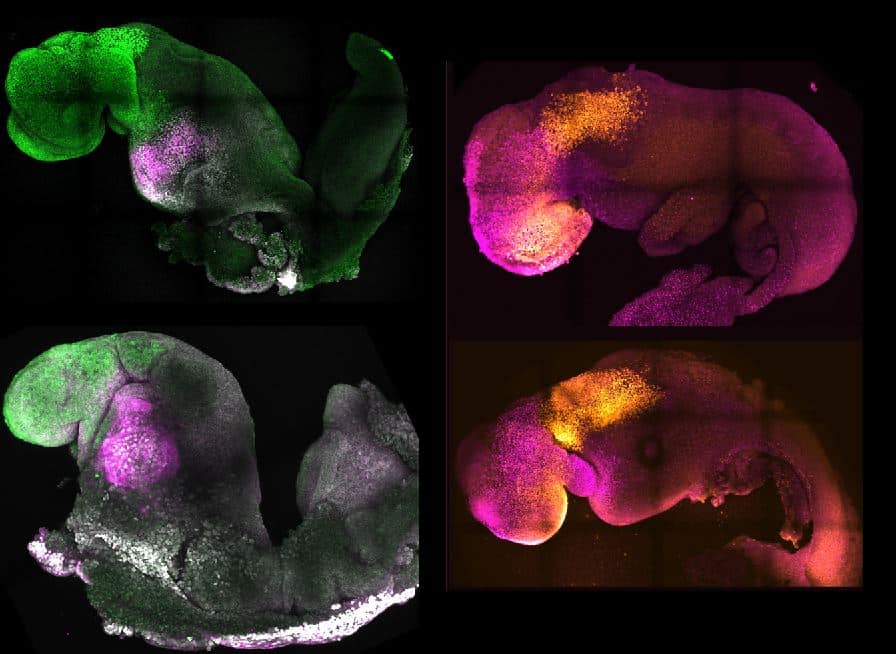
Este último es uno de los objetivos en la mente de Magdalena Zernicka-Goetz, bióloga polaco-británica que acaba de conseguir, tras 10 años de investigación, que su grupo cree embriones sintéticos con cerebro, corazón que late, tubo neural y una estructura biológica muy similar a la de un embrión real. Lo han hecho sin contar con los ingredientes esenciales de la creación de vida. Ni óvulo ni espermatozoide, tan solo células madre, la materia prima del cuerpo capaz de convertirse en células con diferentes funciones.
Como explican los investigadores, para que un embrión con éxito se desarrolle es necesario un "diálogo" entre los tejidos que se convertirán en embrión y los que lo conectarán con la madre. Esto sucede a través de tres tipos de células madre que se forman tras la fecundación. Unas que se convertirán en tejidos del cuerpo, otras que formarán la placenta y otras el saco vitelino, donde crece el embrión.
La publicación en Nature es el fruto de una década de trabajo de creación de embriones tras la que han llegado a un embrión sintético que corresponde a "la segunda semana de gestación de un ratón, lo que correspondería a la tercera semana de embarazo en humanos", explica Zernicka-Goetz a El Independiente por correo electrónico.
Para conseguir que su embrión sintético se desarrollase, el equipo de investigadores juntó las células madre de los tres tipos en un entorno para favorecer su crecimiento y consiguieron llegar, según aseguran, a un estadío que nunca antes se había logrado con un embrión sintético, a generar todo el cerebro. En un comunicado difundido por los investigadores, la autor principal subraya la importancia de esto para estudiar los mecanismos del neurodesarrollo en un modelo sintético. Para comprobar esto, los investigadores eliminaron un gen esencial para la formación del cerebro y comprobaron que los embriones sintéticos sin este gen mostraban exactamente los mismos defectos cuando ocurre en un embrión de un animal con esta mutación. "Esto significa que podemos empezar a aplicar este tipo de enfoque a los muchos genes con función desconocida en el desarrollo del cerebro", afirma Zernicka-Goetz.
La principal aplicación subrayada por la investigadora a El Independiente que puede tener su hallazgo está orientada a la creación de órganos sintéticos para uso humano: "Este modelo nos ayudará a construir mejores modelos de órganos con células madre en humanos y a poder entender cómo se forman los órganos complejos para poder fabricarlos para el trasplante de órganos".
El experimento se desarrolló en un incubador artificial que emula las condiciones fisiológicas del interior del útero de la hembra, como explica el doctor en Biología e investigador Lluis Montolliú en declaraciones al Science Media Centre (SMC). El creador de esa incubadora es coautor del estudio, Jacob Hanna, que ha publicado recientemente resultados similares en Cell. "Sin duda estamos ante una nueva revolución tecnológica, todavía muy ineficiente (es muy difícil conseguir que las células madre generen espontáneamente un embrión sintético), pero con un enorme potencial", afirma Montolliú.
El investigador español afirma que la relevancia de esta investigación recuerda a avances tan espectaculares como el nacimiento de la oveja Dolly en 1997 - el primer mamífero clonado, o las células embrionarias pluripotentes inducibles (IPS), la técnica de reprogramación celular que le valió al científico Shinya Yamakana el Nobel de Medicina en 2012.
También el investigador de Bioingeniería de la Universidad Pompeu Fabra Alfonso Martínez Arias valora la importancia del hallazgo en SMC. "“Este trabajo es una adición importante al publicado por el grupo de Jacob Hanna en Cell hace unos días. Los dos representan un avance importante, pues prueban la necesidad de interacción entre células embrionarias y extraembrionarias en la formación de un mamífero. Más aún, demuestran que es posible iniciar el desarrollo de un mamífero fuera del útero".
No obstante, Martínez plantea destaca el invento "más una ‘prueba de concepto’ que un logro absoluto" en relación al éxito de desarrollo de estos embriones sintéticos (un 1% de los cultivos) así como el hecho de que el desarrollo colapsa tras poco días de cultivo. Así mismo incide en que las estructuras, aun con los elementos de un embrión, "tienen carencias importantes y la mayor parte de esas estructuras están dañadas o incompletas".
El investigador hace estos planteamientos para subrayar la distancia entre lo conseguido y un proceso de creación de vida de esta forma. "La necesidad de hacer hincapié en los defectos y el bajo rendimiento del experimento es importante, pues la idea de que se ha obtenido un embrión de ratón en el cultivo dará lugar a la noción de que pronto se hará lo mismo con células humanas y que se conseguirá un embrión humano. Es muy probable que esto ocurra en el futuro y un valor que tiene este experimento es alertarnos ante esta posibilidad para que consideremos los aspectos éticos de estos experimentos y el impacto social que pueden tener. Desde luego, los dos trabajos son importantes, pero están en unos estadios muy tempranos y habrá que esperar a ver cómo se desarrollan. Mucho más importante será ver qué aplicaciones tiene el sistema. Para dar ese paso, la eficiencia y la precisión tendrán que aumentar. Por el momento, las hembras de ratón hacen embriones perfectos con más eficiencia", explica Martínez.
Te puede interesar
Lo más visto